Was sind die Phasen klinischer Studien?
Autor:
Eugene Taylor
Erstelldatum:
14 August 2021
Aktualisierungsdatum:
1 Juli 2025
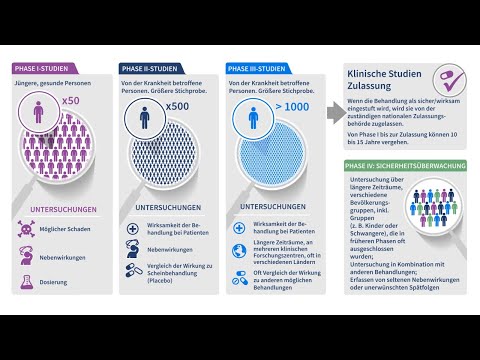
Jede Phase hat einen anderen Zweck und hilft Forschern, unterschiedliche Fragen zu beantworten.
- Phase-I-Studien. Die Forscher testen zum ersten Mal ein Medikament oder eine Behandlung in einer kleinen Gruppe von Menschen (20 bis 80). Der Zweck besteht darin, das Medikament oder die Behandlung zu untersuchen, um mehr über die Sicherheit zu erfahren und Nebenwirkungen zu identifizieren.
- Phase-II-Studien. Das neue Medikament oder die neue Behandlung wird einer größeren Gruppe von Menschen (100 bis 300) verabreicht, um ihre Wirksamkeit zu bestimmen und ihre Sicherheit weiter zu untersuchen.
- Phase-III-Studien. Das neue Medikament oder die neue Behandlung wird einer großen Gruppe von Menschen (1.000 bis 3.000) verabreicht, um ihre Wirksamkeit zu bestätigen, Nebenwirkungen zu überwachen, sie mit Standard- oder ähnlichen Behandlungen zu vergleichen und Informationen zu sammeln, mit denen das neue Medikament oder die neue Behandlung sicher angewendet werden kann.
- Phase-IV-Studien. Nachdem ein Medikament von der FDA zugelassen und der Öffentlichkeit zugänglich gemacht wurde, verfolgen die Forscher seine Sicherheit in der Allgemeinbevölkerung und suchen nach weiteren Informationen über die Vorteile eines Medikaments oder einer Behandlung sowie nach einer optimalen Verwendung.
Wiedergabe mit Genehmigung von NIH Clinical Trials and You. NIH unterstützt oder empfiehlt keine Produkte, Dienstleistungen oder Informationen, die hier von Healthline beschrieben oder angeboten werden. Seite zuletzt überprüft am 20. Oktober 2017.